Nobelio premijos laureatas Robertas Huberis Vilniuje

Priminsime kai kuriuos prof. Roberto Huberio mokslinės biografijos faktus.
Gimė 1937 metais Miunchene. Baigė Miuncheno technikos universitetą, nuo 1960 metų dirbo Makso Planko draugijos Biochemijos institute, kuris taip pat yra netoli Miuncheno. 1971 m.tapo šio instituto direktoriumi, nuo 1976 m. yra Miuncheno technikos universiteto profesorius.
Roberto Huberio mokslinio darbo kryptis – biomolekulių erdvinės struktūros tyrimas rentgenostruktūrinės analizės metodu. 1982 m. R. Huberis su vokiečių biochemiku Johanu Daizenhoferiu (Johann Deisenhofer) iššifravo membraninio baltymo, kuris yra svarbus fotosintezės reakcijoje, trimatę struktūrą. Kristalinį šio baltymo pavyzdį, kuris būtinas rentgenostruktūrinei analizei, gavo dar vienas jų tautietis Hartmutas Michelis (Hartmut Michel). Tai buvo proveržis moksle ir 1988 m. Robertas Huberis, Johanas Daizenhoferis ir Hartmutas Michelis tapo Nobelio premijos laureatais chemijos srityje už intramembraninio baltymo, reikšmingo fotosintezei purpurinėse bakterijose, kristalizavimą ir erdvinės struktūros atskleidimą Rentgeno kristalografijos metodu. Gauti rezultatai padėjo suprasti molekulinius fotosintezės proceso mechanizmus.
Bendradarbiavimo vaisiai saldūs
Viešėdamas Vilniuje prof. Robertas Huberis taip pat lankėsi Vilniaus Universiteto Biotechnologijos institute, su kurio veikla jis tiesiogiai susijęs. Pasak instituto Baltymų-nukleorūgščių sąveikos tyrimų skyriaus vadovo prof. Virginijaus Šikšnio, R. Huberio dėka Biotechnologijos institute buvo pradėti baltymų molekuliniai struktūriniai tyrimai. Prof. R. Huberio laboratorijoje kurį laiką tobulinosi V. Šikšnys, doktorantu buvo jo vadovaujamos laboratorijos mokslo darbuotojas, dabar mokslų daktaras Saulius Gražulis. R. Huberio įkvėpti V. Šikšnys ir S. Gražulis pradėti baltymų molekulių struktūriniai tyrimai Vilniuje. Remdamas jų darbus R. Huberis padovanojo savo laboratorijos tyrimų įrangą Biotechnologijos institutui. Vėliau šiems tyrimams buvo skirta lėšų iš ES Struktūrinių fondų, tad jau spėta įsigyti ir dar tobulesnės įrangos. Pasak V. Šikšnio, Biotechnologijos institute dirbama su esančia įranga, kuri nenusileidžia geriausių šios srities Europos tyrimų centrų įrangai. Baltymų struktūros tyrimams tinkamos Rentgeno spindulių difrakcijos įrangos šiuo metu neturi nei latviai, nei estai.
Prof. R. Huberiui po beveik aštuonerių metų pertraukos buvo labai įdomu apsilankyti Biotechnologijos institute, savo akimis pamatyti naujus pokyčius. Mokslininkas Vilniuje buvo lankęsis 2003 m., tą primena ir nuotrauka, kurioje svečias nusifotografavęs su Baltymų nukleino rūgščių sąveikos tyrimų skyriaus jaunimu. Beje, tai truputį klaidinantis pasakymas, kadangi ne tik toje laboratorijoje, bet ir visame institute nėra senimo, dirba daugiausia jauni darbuotojai. Jų didžiausi moksliniai laimėjimai dar priešakyje, ko gero, kaip ir visam Lietuvos biotechnologijos mokslui. Tą įsimintiną nuotrauką galima išvysti kabančią ant laboratorijos sienos, nuo šiol kabos ir kita, kurioje šio apsilankymo metu Nobelio premijos laureatas nusifotografavo su dvigubai gausesniu darbuotojų kiekiu.
Beje, ir šiuo metu instituto darbuotojai turi kuo didžiuotis, ką patvirtino ir garbusis svečias per savo paskaitą. Lietuvos MA salėje R. Huberis pabrėžė tvirtus Vilniaus Biotechnologijos instituto mokslinius ryšius su Makso Planko draugijos Biochemijos institutu. Bendradarbiaudami šie du institutai nustatė apie 30 proc. visų pasaulyje žinomų restrikcijos endonukleazės erdvinių struktūrų. Tai labai solidus mokslinis įdirbis.
Kuo svarbūs šie darbai? Žinant šių fermentų struktūrinę organizaciją, galima bandyti kurti naujas restrikcijos nukleazes, kurios pasižymėtų kitomis savybėmis, galima mėginti tas savybes keisti norima linkme. Tokie fermentai ateityje gali būti taikomi ne tik molekulinėje biologijoje, bet ir medicinoje – kaip įrankiai genų korekcijai. Šiuo metu ieškoma būdų, kaip tokius fermentus būtų galima transportuoti per ląstelių mebranas ir reguliuoti jų aktyvumą panaudojant, pvz., elektromagnetinę spinduliuotę. DNR modifikacijos tyrimų skyriaus vadovas prof. habil. dr. Saulius Klimašauskas dirba su metilazėmis, kurios perneša metilo grupes į tam tikrą vietą DNR molekulėje. Šiandien vilniečiai biotechnologai pritaiko šiuos fermentus naujų tyrimo instrumentų, kurie naudojami genomo ir kituose tyrimuose, kūrimui.
Baltymų grožio supratimas taip pat keičiasi
Prof. Roberto Huberio vizito į Vilnių organizatoriai pasistengė, kad ir „Mokslo Lietuvos“ atstovas turėtų galimybę pakalbinti žymųjį mokslininką. Turime gerą progą su šiuo pokalbiu supažindinti ir mūsų skaitytojus.
Mokslo Lietuva. Gerbiamasis Profesoriau, kodėl svarbu tyrinėti sudėtingų biomolekulių, pvz., baltymų struktūras?
Robertas Huberis. Pagrindinė priežastis ta, kad norime pamatyti daiktus. Baltymai atlieka tam tikras funkcijas, bet kad suprastume, kaip jie tą daro, mes turime juos, t. y. tas baltymų struktūras, matyti.
ML. Koks ryšys tarp struktūros ir funkcijos? Kaip per struktūrą pasireiškia funkcija?
R. Huberis. Baltymų funkcijos yra labai įvairios ir sudėtingos. Paprastas pavyzdys, du baltymai gali sąveikauti vienas su kitu, jei turi paviršius, kurie dera vienas su kitu, t. y. yra komplementarūs. Tokiu būdu baltymų erdvinė struktūra nulemia jų sąveiką.
ML. Ar iš to išeina, kad trimatė erdvinė struktūra yra labai svarbi sąlyga atsirasti funkcijai?
R. Huberis. Norint suprasti baltymų funkcijas, reikia trijų išmatavimų, t. y. suvokti erdvinę struktūrą, antraip baltymų funkcijų nesuprasime. Jeigu kiekvieną iš mūsų čia esančių „suprojektuotume“ į dvimatę erdvę, tai vargu ar tyrinėtojui tokį dvimatį darinį pavyktų bent kiek suprasti.
ML. O kiek tos trimatės struktūros, kurias stengiasi atskleisti ir tyrinėja biochemikai, atitinka realybę? Gal tai tyrinėtojų saviapgaulė, kai virtualiam, labai supaprastintam vaizdui bandoma suteikti realybės statusą? Kiek virtualus vaizdas kompiuterio ekrane ar nuotraukoje atitinka realybę?
R. Huberis. Norėdami įsitikinti, kad tai, ką matome kristale, yra realu (t. y., kad tokios molekulės iš tikro egzistuoja tirpale, ląstelėje), tenka daryti papildomus eksperimentus. Tik eksperimentu galima įrodyti tos realybės egzistavimą.
ML. Jūsų paskaita buvo skirta baltymų struktūrų grožiui nusakyti. Grožio sąvoka – tai estetinė kategorija. Ir nors baltymų struktūrų grožiu mokslininkai sugeba džiaugtis, žavėtis, bet pačiam baltymui dėl to juk nei šilta, nei šalta.
R. Huberis. Iš tiesų, grožis yra gan subjektyvi kategorija ir ji visų pirma siejasi su pačiu stebėtoju. Tačiau ką mes matome baltymų struktūrose ir kompleksuose? Dažniausiai simetriją, kuri žmogui dažnai kelia pasigėrėjimą ir grožio suvokimo jaudulį. Panašų pojūtį mums sukelia arabų mene paplitusios arabeskos, ornamentai iš augalinių ar geometrinių figūrų. Panašią simetriją mes stebime baltymų struktūrose, ir jos mums šiek tiek siejasi su meno kūriniais.
Kita vertus, nereiktų pamiršti, kad mokslininkai visada šiek tiek pagražina tas sudėtingas molekules, nes realybėje jos nėra tokios spalvingos ir gražios. Tačiau tas pagražinimas padeda jas geriau įsivaizduoti ir suvokti, todėl atskiros jų dalys ir vaizduojamos kitomis spalvomis. Bet tai jau visai subjektyvus pasirinkimas.
ML. Simetrija klasikiniuose menuose gali būti labai svarbus grožio suvokimo elementas, gal net sąlyga. Lygiai kaip muzikoje harmonija, taisyklingas ritmas ir pan. Bet yra atonalinė muzika ir ne vien klasikinis menas. Moderniosios ir postmoderniosios meno srovės kaip tik ėmė dorotis su tradicinio grožio suvokimo pamatais, taigi ir grožio kriterijai per paskutinį šimtmetį gerokai pasikeitė.
R. Huberis. Išties simetrija ir asimetrija tarpusavyje glaudžiai siejasi, mes turime asimetrinius daiktus, kuriuos komponuodami galime išgauti simetriją. Tai dažnai realizuojama sudėtingų baltymų kompleksų struktūrose. Kai Džonas Kendriu (John C. Kendrew, 1962 m. Nobelio premijos laureatas chemijos srityje) nustatė pirmąjį mioglobino modelį, pirmą jo erdvinę struktūrą, tai pradžioje jis ir jo kolegos truputį nusivylė, nes baltymo molekulė buvo asimetriška. Atrodė, kad baltymų molekulės irgi turi turėti simetrinę, panašią į dezoksiribonukleorūgšties (DNR) molekulės dvigubos spiralės struktūrą, kurią kiek anksčiau buvo nustatę amerikietis biologas Džeimsas Votsonas (James Watson) ir anglas fizikas Frencis Krikas (Francis Crik). Tyrinėtojai tikėjosi, kad ir baltymai turės tokias pat gražias, taisyklingas, simetriškas formas, bet tai nepasitvirtino.
Dabar jau mums DNR struktūra darosi nuobodi, o dėl baltymų struktūrų asimetrija tampa vis labiau patrauklesnė. Taigi grožio supratimas keičiasi ne tik menuose ar muzikoje, bet ir baltymų struktūrų tyrinėtojų galvose.
Suvokti kaip ląstelė suserga
ML. 1960 m. baigėte Miuncheno technikos universitetą, tyrinėjote molekulines baltymų struktūras, taikydamas kristolografijos metodus. Ar kristalografijos metodai nėra gyvybės tyrinėjimas numarinus gyvybę? Juk prieš tiriant baltymus rentgeno spindulių difrakcijos metodu reikia juos paversti kristalu.
R. Huberis. Norėdami įrodyti, jog tiriame ne mirusį, bet gyvą daiktą, turime parodyti, kad molekulės kristale atlieka tam tikras joms būdingas funkcijas. Galima parodyti, kad tas mūsų tiriamas mėginys kristale yra toks pats veiklus, kaip ir mūsų ląstelėse.
ML. Ar visi baltymai pasižymi tokiomis savybėmis?
R. Huberis. Tai bendras visų tiriamų baltymų struktūrų požymis – tos struktūros kristale išlieka gyvos. Fotosistema, apie kurią kalbėjau savo paskaitoje, išlieka aktyvi kristale, ir galima registruoti kristale esančio baltymo biocheminius signalus.
ML. Tai gyvybės signalai?
R. Huberis. Iš tikrųjų, tai signalas, kuris matomas ir gyvose sistemose.
ML. Baltymų tyrimuose be molekulinės kristalografijos metodų naudojamas ir magnetinis branduolių rezonansas. Ar šis metodas nėra pranašesnis? Bent jau skeptikams gal netektų abejoti, ką tiriame – gyvą ar gyvybės ženklus praradusią baltymų struktūrą?
R. Huberis. Magnetinio branduolių rezonanso metodas pirmiausiai taikomas mažiems baltymams tirti. Jeigu norime didesnės struktūros baltymus tyrinėti (o tai dažniausiai didelės struktūros ir jų kompleksai), tai taikytina tik molekulinė kristalografija. Nė vienas iš sudėtingų baltymų, kuriuos šiandien per paskaitą demonstravau, negalėjo būti ištirtas magnetinio branduolių rezonanso metodu. Tos struktūros paprasčiausiai per didelės.
ML. 1988 m. kartu su dviem kolegomis biochemikais iš Vokietijos tapote Nobelio premijos laureatu. Kokią naudą per prabėgusius metus Jūsų su kolegomis atradimo rezultatai davė mokslui, kitų tyrinėtojų rezultatams? Ar po Jūsų darbų buvo šios krypties naujų atradimų, o jei taip, tai kokių?
R. Huberis. Mūsų atradime padaryti trys svarbiausi dalykai. Pirma, nustatyta didžiausia tuo laiku baltymo struktūra. Antra, tai pareikalavo naujų ir ligi tol nenaudotų technologinių sprendimų. Ir trečia, mūsų eksperimentai padėjo atsakyti į klausimą, kaip šviesa, esanti ląstelės membranoje, patenka į baltymą ir paverčiama elektros signalu. Kitaip tariant, kaip iš saulės ateinanti energija patenka į augalus ir virsta kitos rūšies energija. Tos rūšies, nuo kurios visi mes, taip pat ir kiti gyvūnai faktiškai priklauso: naudodami tuos augalus maistui mes pasinaudojame iš saulės Žemę pasiekusia energija.
ML. Kurlink juda proteomika, t. y.visų genomo koduojamų baltymų struktūros ir funkcijos tyrimai? Apskritai, kokių svarbiausių tikslų siekiama tyrinėjant baltymų pasaulį?
R. Huberis. Vienas svarbiausių dalykų, kuriuos norima suprasti tiriant proteomą, t. y., ląstelės sintetinamų baltymų visumą, yra pokyčiai, kurie apsprendžia, kaip ląstelė pereina iš „sveikos“ būsenos į tam tikrą „negalią“, t. y. ligos būseną. Šio proceso, to pokyčio mechanizmo atsiradimas ir supratimas yra labai svarbus.
ML. 1971 m. tapote Makso Planko draugijos Biochemijos instituto direktoriumi. Labai jaunas amžius tapti tokio autoritetingo instituto direktoriumi. Kaip Jums tai pavyko? Nejau buvusioje Vakarų Vokietijoje anuomet tai buvo būdinga?
R. Huberis. O, ne, tai buvo visiškai netipiška. Istorija pusiau anekdotinė. Labai didžiavausi, kad tapau jauniausiu Makso Planko draugijos instituto direktoriumi. Tuo metu Makso Planko draugijos prezidentas buvo žymus chemikas prof. Adolfas Butenantas (Adolf Butenandt; yra Butenanto cheminė reakcija; už lytinių hormonų tyrimus 1939 m. jis gavo pusę Nobelio premijos chemijos srityje, kitą dalį gavo Leopoldas Ruzicka). Kai po kelerių metų sutikau prof. A. Butenantą, truputį pasigyriau: „Profesoriau, ar žinote, kad esu jauniausias Makso Planko instituto direktorius?“ Butenantas atsakė: „Gerbiamasis profesoriau Huberi, aš tai žinau, bet noriu priminti, kad šis privalumas labai greitai praeis“.
ML. Labai gaila, kad nepastebimai praėjo ir šiam pašnekesiui skirtas laikas. Labai Jums dėkoju, profesoriau Robertai Huberi, už „Mokslo Lietuvai“ skirtą laiką ir išsakytas mintis.
Pabaigai
Belieka pasakyti, kad 2005 m. R. Huberis pasitraukė iš Makso Planko draugijos Biochemijos instituto direktoriaus pareigų ir tais pačiais metais tapo šio instituto struktūrinių tyrimų grupės garbės direktoriumi – Direktor Emeritus. Šiuo metu prof. R. Huberis atsakingas už Kardifo universiteto struktūrinės biologijos plėtrą, atlieka mokslinius tyrimus Duisburgo-Eseno universiteto Medicininės biotechnologijos centre ir Barselonos Universitete. Jis taip pat yra žurnalo „Journal of Molecular Biology“ redaktorius ir dviejų biotechnologijos kompanijų – „Proteros“ ir „SupreMol“ vienas įkūrėjų ir konsultantų, taip pat tarptautinių farmacijos ir augalininkystės kompanijų mokslinis konsultantas.
Gediminas Zemlickas
Nuotraukose:
Nobelio premijos laureato prof. Roberto Huberio diskusija su Vilniaus universiteto studentais biochemikais užsimezgė po paskaitos Lietuvos Mokslo akademijos salėje; šalia R. Huberio – prof. Virginijus Šikšnys
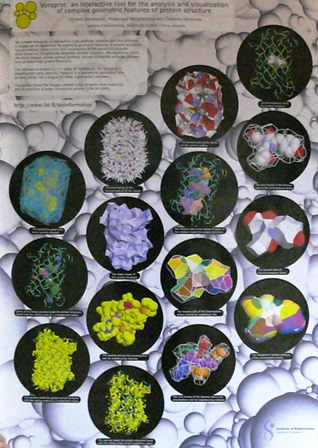
Egzotiškas baltymų struktūrų grožis
Profesorius Robertas Huberis su Vilniaus universiteto Biotechnologijos instituto Baltymų-nukleorūgščių skyriaus studentais ir tyrėjais
Prof. Robertui Huberiui lankantis Biotechnologijos instituto Bioinformatikos skyriuje kilo spontaniška diskusija su dr. Česlovu Venclovu, dr. Sauliumi Gražuliu ir Virginijumi Šikšniu apie baltymų-šaperonų funkcijas
Vilniaus Universiteto studentai dirbdami Biotechnologijos Instituto laboratorijose įgyja praktinių įgūdžių